医療機器の設計開発プロセスにおける規格対応
医療機器の設計開発プロセスにおいては、様々な規格に対応する必要があります。
その種類や要求事項は多岐に渡り、医療機器開発におけるひとつの課題となっています。
サン・フレアでは、薬機法や海外薬事に係る手続きを見据えて、ISO 14971やIEC 62366等の医療機器の各種規格対応支援を行います。
医療機器の製造販売プロセス
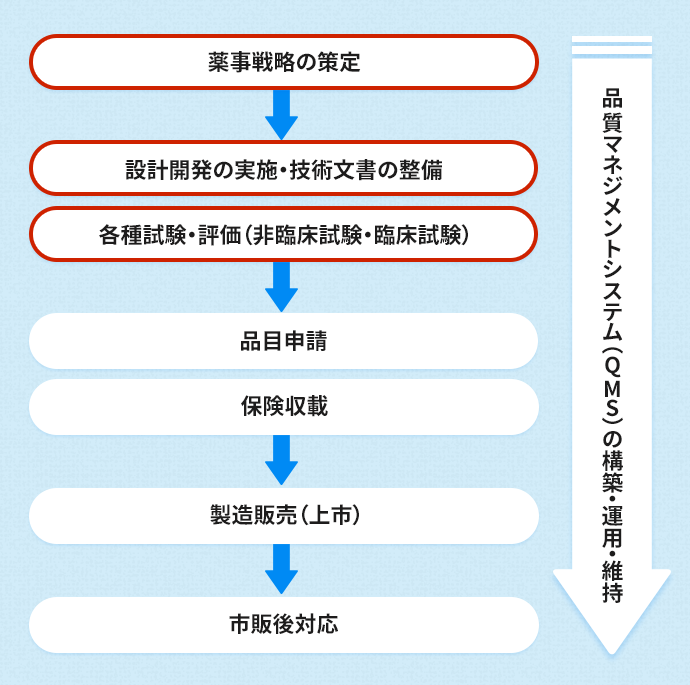
*赤で囲った設計開発や各種試験・評価までのプロセスにおいて、各種規格対応が必須となる。
目次に戻る
サン・フレアのコンサルティング内容
設計開発および技術文書の整備に関するコンサルティング
日本国内および海外展開を見据えた設計インプットの整理、各種技術文書の整備支援を行います。
- 対象機器に係る要求事項、適用規格の調査(日米欧、または世界各国における要求事項、適用規格を含む)
- 上記要求事項、適用規格に対する現状とのギャップ分析およびギャップ対応支援
- 事例1:基本要件基準(日本)と現状とのギャップ
※日本国内における薬事支援に関する詳細はこちらのページをご確認ください。
- 事例2:GSPR* (欧州)と現状とのギャップ
*GSPR:安全性および性能に関する一般要求事項(General Safety and Performance Requirements)
※欧州CEマーキング支援に関する詳細はこちらのページをご確認ください。
- 性能および安全性に関する規格の設定と検証方法の共同検討
- 対象機器の非臨床試験および臨床試験における評価項目の検討
- 設計検証および妥当性確認の実施に関する助言提供
目次に戻る
主要な医療機器関連規格に関するコンサルティング
医用電気機器規格(JIS T 0601-1 (IEC 60601-1 第3.1版)) 対応
- JIS T 0601-1 (IEC 60601-1 第3.1版)に関する詳細レクチャー(研修修了証の発行)
- 貴社現状とのギャップ分析およびギャップ対応支援
- ユーザビリティエンジニアリング要求事項への対応(IEC 60601-1-6)
- 手順書および文書サンプルの提供
- 試験計画書案のドラフティング
リスクマネジメント規格 (JIS T 14971(ISO 14971)) 対応
- ISO 14971に関する詳細レクチャー(研修修了証の発行)
- 意図する使用および医療機器の安全に関する特質の共同検討
- リスクマネジメントにおけるハザード、危険状態、危害などの特定を目的とした共同検討
- リスクマネジメント計画書等のリスクマネジメントファイルサンプルの提供
ユーザビリティエンジニアリング規格(JIS T 62366(IEC 62366)) 対応
- IEC 62366に関する詳細レクチャー(研修修了証の発行)
- ユーザビリティエンジニアリングファイルのサンプル提供
- 貴社作成ユーザビリティエンジニアリングファイルのレビューおよびフィードバック
- ユーザビリティエンジニアリングファイルのドラフティング
医療機器ソフトウェア規格(JIS T 2304(IEC 62304) )対応
- JIS T 2304(IEC 62304)に関する詳細レクチャー(研修修了証の発行)
- 貴社現状とのギャップ分析およびギャップ対応支援
- 手順書および文書テンプレートの提供
- 貴社作成ソフトウェアライフサイクルプロセス関連文書のレビューおよびフィードバック
- ソフトウェアライフサイクルプロセス関連文書のドラフティング
医療機器の生物学的安全性評価規格(JIS T 0993(ISO 10993)シリーズ)対応
- JIS T 0993(ISO 10993)シリーズに関する詳細レクチャー(研修修了証の発行)
- 新/旧版の規格差分調査・分析(ISO 10993-1:2009 VS ISO 10993-1:2018 等)
- 生物学的安全性評価における考慮すべき評価項目の共同検討
- 生物学的安全性評価報告書のドラフティング
目次に戻る
各国規格要求事項の差分分析
各国の性能および安全性に関する規格、QMS規格等の差分分析を行ないます。
詳細は「規格・規制等の要求事項に関する差分調査」のページをご覧ください。
目次に戻る
国内・海外薬事コンサルティングへのお問い合わせ
下記フォームよりお問い合わせください。

